Главное меню
Вы здесь
Взаимодействие с азотом и водородом при сварке плавлением
Основным источником азота при сварке является воздух. Молекулярный азот при высоких температурах диссоциирует на атомы
N2 = 2N – 170200 кал/моль.
Частично в присутствии кислорода при высоких температурах образуются и окислы азота, в частности NO.
Азот в некоторых металлах (медь, серебро, золото) практически нерастворим и может применяться при сварке таких металлов как защитный нейтральный (инертный) газ.
В железе и железных сплавах азот растворяется и при температурах ниже 600°С образует химические соединения – нитриды Fe2N, Fe4N. Зависимость растворимости азота в твердом и жидком железе от температуры показана на рис. 1.
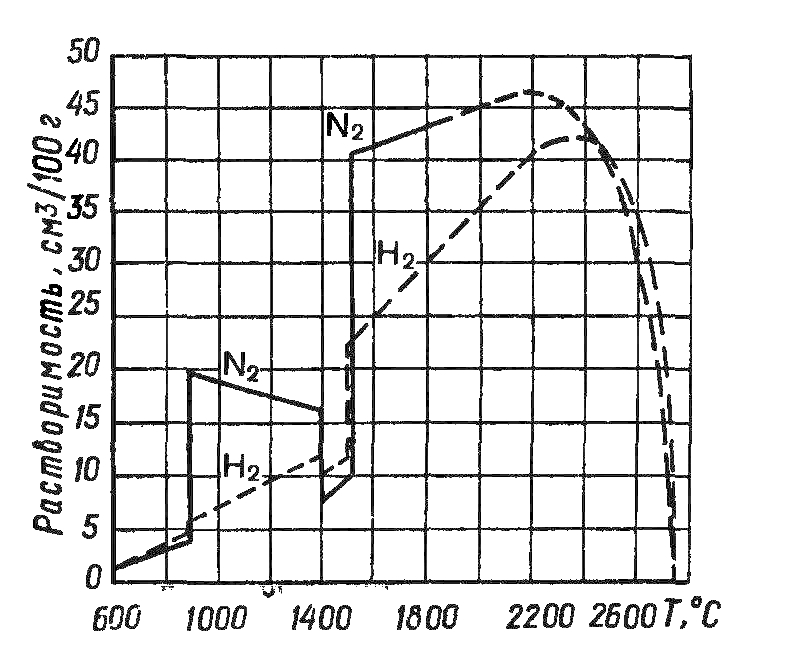
Рис. 1. Зависимость растворимости азота и водорода в железе от температуры.
При переходе железа из жидкого состояния в твердое растворимость азота скачкообразно уменьшается; газ стремится из раствора в виде газовой фазы (нитриды при этих температурах не образуются), что может привести к образованию пор.
Источником водорода при сварке являются продукты горючих углеводородов (при газовой сварке) и углеводов из покрытий, а также продукты диссоциации паров воды.
Водород в газовой фазе может присутствовать в виде молекулярного, атомарного и ионизированного. Ионизация водорода происходит по реакции
Н2 = Н + Н+ + е- - 417480 кал/моль.
Различные металлы по-разному взаимодействуют с водородом. Одни из них (титан, тантал, ниобий, ванадий и др.) образуют с водородом химические соединения – гидриды (как правило, ухудшающие свойства металла). Многие гидридобразующие металлы сильно поглощают водород и в твердом состоянии. При более высоких температурах гидриды распадаются, вследствие чего водород может выделяться из металла (у титана при температурах более 700°С).
Другая группа металлов (железо, никель, кобальт, медь) гидридов не образует. Водород адсорбируется этими металлами; при плавлении растворимость водорода резко повышается. Растворимость водорода при постоянной температуре подчиняется зависимостям:
[Н] = К1рН; [Н] = К2√(рН2),
где К1, К2 – коэффициенты, зависящие от температуры; рН и рН2 – парциальные давления водорода (атомарного и молекулярного) в газовой фазе.
Общий характер изменения растворимости водорода в железе при различных температурах и рН2 = 1 кгс/см2 показан на рис. 1.
Для жидкого железа растворимость водорода [Н] (см3/100г) в зависимости от парциального давления рН2 (мм рт.ст.):
lg[H]ж = 0,5lg pH2 – 1745/Т + 0,888.
Часть водорода со временем удаляется из металла диффузией, а часть остается в металле в различных несплошностях. И диффузионно-подвижный остаточный водород в целом ухудшают свойства сварных соединений, в связи с чем его количество в металле следует ограничивать. Ограничение содержания водорода в металле в основном достигается уменьшением парциального давления свободного водорода в газовой фазе при сварке. Для этого:
1.Удаление и ограничение источников водорода при сварке;
2.Связывание газообразного водорода в стойкие при высоких температурах соединения;
3.Уменьшение растворимости водорода в жидком металле, в частности его окислением.
Методы удаления источников водорода сводятся к предварительной очистке кромок от водных окислов (например, ржавчины), их просушке от адсорбированной воды, очистке электродной проволоки от жиров, просушке и прокалке сварочных материалов (электродов, флюсов), предохранению флюсов от засорения ржавчиной и пр.
Связывание водорода в условиях сварки осуществляется либо во фтористый водород (HF), либо в гидроксил (ОН). Более распространенным является связывание во фтористый водород:
2CaF2 + 3SiO2 = 2CaSiO3 + SiF4
SiF4 + 3H = SiF + 3HF
SiF4 + 2H2O = SiO2 + 4HF.
Окисленность металла приводит к снижению содержания в нем водорода. Поэтому хорошо раскисленный металл является более чувствительным к водороду газовой фазы и требует применения более сильных мер защиты (введения фторидов, прокалки сварочных материалов и пр.).
- Войдите, чтобы оставлять комментарии
